ADC是什么:
抗体偶联药物(Antibody-Drug-Conjugate,ADC),通过将小分子化学药物偶联至抗体上,同时发挥抗体靶点特异性和小分子杀伤性的作用,是癌症治疗的一个热门方向。
ADC的概念图
ADC分子由三部分构成,分别是抗体,连接子 (linker) 和毒性分子 (Payload):
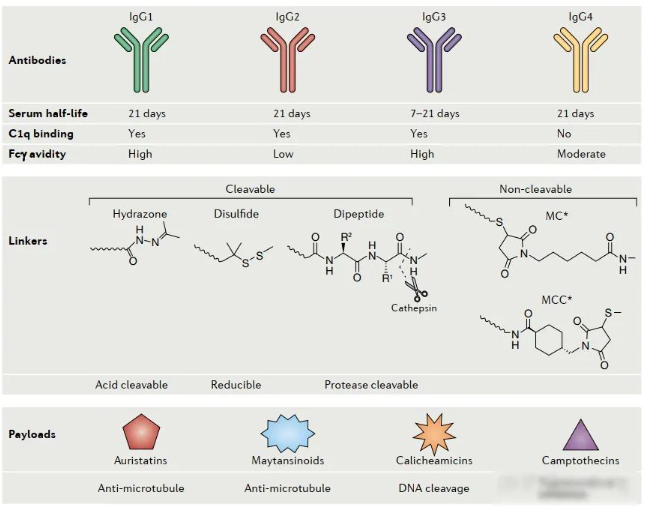
抗体(antibody)
在抗体类型的选择上,人们一般偏爱IgG,尤其是IgG1。与其他几种IgG相比,IgG1可以在与靶细胞结合后能够诱导多种免疫反应,如ADCC和CDC,这对于ADC对肿瘤细胞的杀伤来讲无疑是一个锦上添花的过程。
(1)靶抗原:有效ADC的理想表位必须在细胞外,因为ADC与靶标复合物需要通过受体介导的内吞作用而内化,以使其效应物有效载荷在细胞内释放;理想的靶抗原应在靶细胞表面均匀表达,并在健康组织中低表达,以限制靶标的肿瘤外毒性;理想抗原的脱落也应尽可能少,以防止游离抗原结合血液循环中的mAb,从而使后者提前失活。
(2)抗体:抗体具有两个介导抗原识别的抗原结合片段(也称为Fabs)和一个介导抗体与免疫系统效应细胞相互作用的恒定片段(Fc),Fc部分还包含与调节血清蛋白半衰期的新生Fc受体(FcRn)的结合结构域。ADC中mAb组分的理想特性包括:通过选择人源抗体或全人源抗体获得最小的免疫原性;靶标特异性(具有足够的抗原特异性和亲和力)和有效的内吞作用;循环半衰期长。免疫球蛋白的IgG类型(特别是IgG1亚型)是用于抗体治疗以及循环中最常见的抗体类型。
毒素(drug)
目前上市的或研发中的ADC使用的毒素基本为已经上市的化疗药物。大体上有以下几种作用机制:
(1)靶向DNA:破坏DNA的药物是靶向DNA小沟的天然产物抗生素,加利车霉素可诱导双链断裂,而双霉素和PBD则通过在富含AT的区域(双霉素)和鸟嘌呤残基(PDB)上特异性结合而引起DNA烷基化。
(2)靶向微管蛋白:微管蛋白抑制剂MMAE和MMAF抑制微管聚合,导致G2/M期细胞周期停滞。
除效力外,细胞毒性有效载荷的分子和物理化学性质也是ADC功效的决定性因素。选择ADC有效负载的基本标准是是否具有共轭性,溶解性和稳定性。分子结构应该允许药物与linker基团偶联,因为ADC是在水溶液中制备并静脉内给药,所以水溶性和在血液中的长期稳定性十分重要。
连接物(linker)
Linker将细胞毒性有效负载连接至mAb,并维持ADC在系统循环中的稳定性。在稳定性,药代动力学和药效学性质以及治疗窗口等方面,linker的化学性质和结合位点在ADC性能中起着至关重要的作用,具体包括:
(1)稳定性:linker需要有足够的稳定性,以使ADC分子在血液循环中定位于目标部位前不会过早切割,这会导致非特异性毒性;
(2)载荷释放:在胞吞内化过程中linker能够迅速分裂以释放有效载荷。Linker上的二硫键,硫醚等官能团将mAb与有效负载连接。基于有效负载释放机制,当前常用的linker分为可裂解的或不可裂解的。可裂解的linker取决于生理环境,例如在低pH(酸性环境下不稳定的linker),蛋白水解(蛋白酶可切割的linker)或胞内高谷胱甘肽浓度(二硫键linker)条件下释放ADC中的有效载荷;不可裂解的linker与mAb的氨基酸残基形成不可还原键,因此在血液循环中更为稳定,它依赖于mAb的溶酶体降解以释放有效负载,因此需要有效的内化过程和向溶酶体的最佳转运。
(3)共轭结构:Linker的共轭位点可以增强ADC的药理作用,在控制ADC的治疗窗口方面起着重要作用。药物与抗体之比(DAR)或与mAb相连的药物分子数量对于确定ADC的效力和毒性至关重要。共轭发生在mAb主链上(通过暴露在mAb表面的赖氨酸侧链形成或通过在铰链区形成链间二硫键的半胱氨酸残基形成),导致DAR的高变异性(0~8)。需要注意的是,高载药量可以提高ADC效能也可能增加脱靶效应,较高的DAR还会增加药物清除率,从而导致循环半衰期缩短。
ADC的发展史
抗体药物的研发技术一直在不断更新换代,ADC的研究可以追溯到1980年,但是直到2000年,首个抗体偶联药物才被FDA批准用于治疗急性粒细胞白血病,但由于致死性的毒性的产生,于2010年撤市。随着原有技术的改进,研究人员开发了新型抗体偶联药物,并于2011年被FDA批准用于治疗霍奇金淋巴瘤和系统性间变性大细胞淋巴瘤。2013年抗体偶联药物再次取得突破,Genentech/ImmunoGen联合开发的Ado-trastuzumabemtansine被FDA批准用于HER2阳性乳腺癌,这是首个针对实体瘤的抗体偶联药物。随着这两个药物的研发成功,ADC药物再次以火热的状态进入人们的研究视野。
第一代ADC
在第一代ADC药物中,主要通过不可降解的连接子与小鼠单克隆抗体结合,药效和活性均较低。
第一代ADC药物失败的原因有很多因素,首先就是药物效力不足,血液中药物浓度低于治疗有效浓度,而靶点抗原低表达又导致药物递送量少,细胞内药物不足以杀死细胞。其次,初代ADC药物对肿瘤的靶向性不强,定位率低,而当时使用的连接子也不稳定,以致于药物毒性较大。最后,由于早期ADC中单克隆抗体是鼠源而不是人源化抗体,导致免疫反应和人抗鼠抗体(HAMAs)的产生。以上都是第一代药物失败的因素,但是研究永无止境,很快第二代ADC药物进入人们的视野。
第二代ADC
第二代ADC药物的研发中,mAb技术得到改进,单克隆抗体被仔细选择,提高了肿瘤细胞靶向性,并减少与健康细胞交叉反应。更重要的是,早期使用当时治疗癌症的小分子药物作为毒性荷载缺乏临床研究,后来发现了更有效的小分子物质。与第一代ADC相比,第二代ADC具有更好的CMC特性。从当时FDA批准的三种二代ADC药物来看(vedotin、emtansine、ozogamicin),
第二代ADC药物显示出良好的临床疗效和安全性。
然而,由于脱靶毒性、存在未结合抗体以及药物抗体比(DAR)为8引起的ADC聚集或快速清除等原因,目前大多数第二代 ADC显示出较窄的治疗窗口。此外,DAR>4的ADC被证明耐受性低、体内疗效低但是血浆清除率高。至此,二代ADC药物也难以满足患者的需求。优化单克隆抗体(mAbs)、连接物和结合化学物质可以提高第三代ADC的疗效,位点特异性偶联现在被认为是ADC成功开发的关键。
第三代ADC
第三代ADC药物综合了一代二代失败的因素,利用小分子药物与单克隆抗体的位点特异性结合,产生DARs为2或4的ADC,这种ADC药物毒性降低,无未结合的单克隆抗体,稳定性和药代动力学大大提高,偶联脱落速度更低,药物活性高,低抗原水平下的细胞活性高。综上所述,第三代ADC药物攻克了导致一代二代药物失败的因素,让患者得到更好的治疗。
ADC现状
尽管已经有几十年的研发历史, ADC依然有巨大的改良空间。因为靶点清楚、技术成熟、选择性好等优点,抗体药物偶联物研究在未来几年里预计继续成为抗癌领域的研究热点。据悉本月11日,美国FDA宣布加速批准基因泰克的抗体偶联药物Polivy(polatuzumab vedotin-piiq)上市,与苯达莫司汀与rituximab联合使用,治疗难治的弥漫性大B细胞淋巴瘤成人患者。FDA指出,针对这一疾病,这也是首款免疫化疗(chemoimmunotherapy)。希望这款创新药能够尽快研制成功,也期待各大药企在未来研发更多更优质的ADC药物,能够为更多患者带来新的治疗方案。
 在线客服1号
在线客服1号




